最後更新於 2023 年 7 月 11 日
牙齒保健之評估方法由民國88年8月公告至今尚未重新修正過,現提出新版牙齒保健功效評估方法之最大的差異點在於舊方法中原可選擇執行動物或人體試驗,但新方法中只能執行人體試驗。此次公告核可宣稱為「有助於提升口腔內牙菌斑酸鹼值」、「有助於減少口腔內牙菌斑堆積量」、「有助於減少口腔內牙菌斑內突變形鏈球菌數量」或其他相近具科學依據詞句之宣稱。
健康食品之牙齒保健功效評估方法
壹、依據
健康食品管理法第三條第二項。
貳、前言
本評估方法採用人體口腔牙菌斑相關檢測指標,作為評估受試產品牙齒保健功效之替代性指標(surrogate endpoints)。牙菌斑(dental plaque)是附著於口腔牙齒表面之一層膜,亦稱為牙生物膜(dental biofilm),牙菌斑內細菌包括各種球菌、桿菌及纖毛菌,其中最容易引發齲齒之牙菌斑細菌為突變形鏈球菌(Streptococcus mutans)。減少口腔內前述細菌數量,可降低齲齒之發生率。
參、適用範圍
本方法適用於申請健康食品之牙齒保健功效宣稱之受試產品評估試驗,惟就本評估方法所載之檢測指標,申請者得以符合科學與倫理原則,且被醫學所認可之其他更嚴謹之檢測方法進行,並檢附其參考資料。
肆、評估試驗要件與檢測方法
受試產品安全評估分類為第二類以上者,於執行人體食用研究前,應先完成安全評估試驗,並以足夠之安全倍數作為人體食用研究之測試劑量。試驗應選擇本評估方法所載之牙齒保健相關指標檢測,試驗原始數據紀錄必須保留供查核。
一、執行單位與執行人
本評估試驗應委託具有充分設備之國內外大學食品、營養、醫藥、牙醫及其他相關研究所、教學醫院或具公信力之研究機構執行。試驗計畫主持人必須具備牙科學、牙周病學、齲齒學或口腔科學相關之專業背景與研究經驗或著作。
試驗應有牙醫師參與,必要時得請其他醫事人員協助,並遵守赫爾辛基宣言之精神,且試驗前須經執行單位或相關之人體試驗審查委員會(Institutional Review Board, IRB)或研究倫理委員會(Research Ethics Committee, REC)之核准,始得開始進行試驗,試驗報告須檢附IRB或REC同意書。
二、受試對象
(一) 納入條件,同時符合下列條件者
- 年齡二十歲以上;
- 每毫升唾液中有105以上之突變形鏈球菌菌落數(colony forming unit, CFU),且唾液菌落數採取之時機點,每一納入對象均應相同(如:飯後,刷牙前等),由執行單位決定之;
- 自然牙齒數量至少二十顆。
(二) 排除條件
經篩檢發現有下列情形之一者,不得納入:
- 現在有抽菸或嚼檳榔,或過去有之習慣。
- 妊娠或哺乳中之婦女。
- 罹患系統性疾病,如心血管疾病、糖尿病、呼吸系統疾病、癌症、自體免疫疾病、嚴重牙周病、其他重大器官疾病或口腔疾病。
- 服用經醫師判斷影響評估指標之藥物。
- 其他經醫師判定不宜參與試驗。
(三) 退出條件
於試驗過程中,有下列情形之一者,應退出試驗:
- 受試者對受試產品不適或未按照規定食用受試產品。
- 因資料不全影響功效或安全性判斷。
- 經醫師判定不宜繼續進行試驗。
(四) 詳細記錄退出試驗者之退出原因及時間,留意與退出原因有關之生理指標,必要時製作紀錄。
三、試驗分組模式
相近條件之受試者以雙盲、隨機、平行對照(double-blind, randomized, parallel-controlled)方式,平均分配至「試驗組」或「對照組」,兩組之恆齒齲蝕指數(Decayed, Missing and Filled Teeth index, DMFT Index)範圍應相當,分別給予受試產品或外型與味道相近之安慰劑。在試驗期間,受試者應維持日常規律之飲食習慣及口腔衛生習慣並記錄之,不可使用漱口水,不可食用與受試產品相關之其他食品,若有服用藥物應記錄並告知。
四、受試人數
試驗完成後之可評估人數,應以評估指標改善程度之統計檢定力(statistical power)可達 80%為據,每組並不得少於三十人。
五、試驗劑量
試驗劑量應至少包括產品上市之建議劑量,且必須在安全範圍內。
六、試驗流程
試驗流程如下圖所示,為期至少六週:
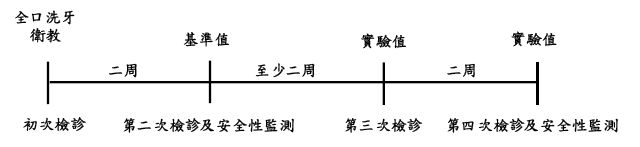
初次檢診時,檢查自願參與試驗者之自然牙齒數量、DMFT index及收集唾液檢體,並予全口洗牙,且衛教所有自願參與試驗者維持日常規律之飲食習慣與口腔衛生習慣;依納入及排除條件,篩選符合之受試者參與後續試驗流程。
第二次檢診取得之檢測指標測量值為基準值(baseline level),並於此次檢診提供受試者受試產品或安慰劑。第三次及第四次檢診,取得之檢測指標測量值為實驗值(experimental level)。
第二次、第三次及第四次檢診前四十八小時開始,受試者不可刷牙及不可使用牙線,直至檢診完後,始能恢復原先之口腔衛生習慣。第二次、第三次及第四次檢診前六小時,受試者不可進食但可喝水。檢診前二小時,受試者不可進食及喝水。
七、檢測指標
(一) 牙菌斑酸鹼值。
(二) 牙菌斑堆積量。
(三) 牙菌斑內突變形鏈球菌數量。
八、檢測執行時點
(一) 第二次及第三次檢診:
- 靜止狀態時牙菌斑酸鹼值。
- 牙菌斑堆積量。
- 牙菌斑內突變形鏈球菌數量。
(二) 第四次檢診:食入蔗糖水後牙菌斑酸鹼值。
九、檢測方法
(一) 牙菌斑酸鹼值
同一位受試者之牙菌斑酸鹼值測量應由同一位牙醫師執行,並應訂有標準操作流程;由不同牙醫師執行者,應於執行前完成執行者間信度統計分析。
利用連接微電極之酸鹼值測量器,測定受試者上下左右顎共四側之固定牙位齒間(interdental)牙菌斑酸鹼值,並將四處牙位齒間牙菌斑酸鹼值之平均值作為該受試者之牙菌斑酸鹼值。
(二) 牙菌斑堆積量
同一位受試者之牙菌斑收集應由同一位牙醫師執行,並應訂有標準操作流程;由不同牙醫師執行者,應於執行前完成執行者間信度統計分析。
牙菌斑酸鹼值檢測完畢後,以牙周刮匙(periodontal curette)將牙齒上所有可收集之牙齦上牙菌斑(supragingival plaque)刮下,收集並立即秤重(wet weight)。
(三) 牙菌斑內突變形鏈球菌數量
突變形鏈球菌菌落數:將一毫克牙菌斑置入一毫升 0.05 M磷酸緩衝液(phosphate buffer, pH 7.3)中,並輕輕攪拌三十秒後,經連續稀釋後之牙菌斑溶液塗於MSB培養基(mitis salivarius bacitracin agar)上,於37℃、5% CO2及95% N2環境培養三天後,計算菌落數(CFU/mL)。全菌菌落數:以連續稀釋後之牙菌斑溶液塗於BHI 培養基(brain heart infusion agar)上,於37℃、5% CO2及95% N2環境培養五天後,計算全菌之菌落數(CFU/mL)。
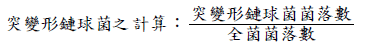
十、檢測值之評估
(一) 牙菌斑酸鹼值
- 靜止狀態時,牙菌斑酸鹼值(resting pH value)之影響:
第三次檢診所得之實驗值扣除基準值,其差異即為受試產品對口腔內靜止狀態之牙菌斑酸鹼值之影響。 - 食入蔗糖水後,牙菌斑酸鹼值之影響:
受試者先檢測牙菌斑起始酸鹼值後,含入十五毫升10%蔗糖水二分鐘,吐出蔗糖水,再食入受試產品或安慰劑一定之時間。在吐出蔗糖水後第二、五、十、二十、三十、四十五、六十分鐘,分別測量牙菌斑酸鹼值,並以Stephan curve進行分析,計算各時間點牙菌斑酸鹼值變化,相對於起始酸鹼值之曲線下面積(delta area under the curve, ΔAUC)。
(二) 牙菌斑堆積量
第三次檢診所得之實驗值扣除基準值,其差異即為受試產品對牙菌斑堆積量變化之影響。
(三) 牙菌斑內突變形鏈球菌數量
第三次檢診所得之實驗值與基準值之差異,即為受試產品對牙菌斑內突變形鏈球菌數量變化之影響。
十一、安全性監測
(一) 一般狀況
基於受試者安全性考量,應於試驗期間第二次檢診及第四次檢診時,由醫事人員執行下列安全性監測,並記錄之:
受試者之精神狀況、體重、睡眠、厭食以及有無其他腸胃症狀,並測量血壓、脈搏及呼吸次數。
(二) 血液常規檢查
血中紅血球細胞數目(RBC count)、白血球細胞數目(WBC count)、血色素(Hb)、血容比(Hct)、平均紅血球容積(MCV)等項目。
(三) 血液生化分析
三酸甘油酯、總膽固醇、血糖、天門冬氨酸氨基轉移酶(AST)、丙氨酸轉氨酶 (ALT)、丙麩胺酸轉移酶(γ-GT)、白蛋白(Albumin)、尿素氮(BUN)、 肌酸酐(creatinine)、尿酸、血鈉及血鉀等項目。
(四) 尿液常規檢查
尿液酸鹼值、尿蛋白、尿糖等項目。
(五) 心電圖檢測
十二、數據之統計分析
採用配對t檢定(paired t test)或威爾卡森符號等級檢定(Wilcoxon signedrank test)評估各組內是否具統計顯著差異(p < 0.05);另,得採用獨立樣本t檢定(independent-sample t test)或威爾卡森等級和檢定(Wilcoxon rank sum test)比較各組間是否具統計顯著差異(p < 0.05)。
十三、測定結果之判定
(一) 同時符合下列條件者,有提升口腔內牙菌斑酸鹼值之效果:
- 試驗組靜止狀態時牙菌斑酸鹼值之第三次檢診實驗值,相對於基準值有顯著上升(p<0.05);
- 試驗組與對照組相比,靜止狀態時牙菌斑酸鹼值之改善具有顯著差異(p<0.05);
- 試驗組與對照組之ΔAUC相比具顯著改善(p<0.05)。
(二) 同時符合下列條件者,有減少口腔內牙菌斑堆積之效果:
- 試驗組有50%以上之受試者,其牙菌斑堆積量降低20%以上;
- 試驗組與對照組相比,牙菌斑堆積量降低具顯著差異(p<0.05)。
(三) 同時符合下列條件者,有減少口腔內牙菌斑內突變形鏈球菌數量之效果:
- 試驗組有50%以上之受試者,其突變形鏈球菌數量降低之變化率20%以上;
- 試驗組與對照組相比,突變形鏈球菌數量降低具顯著差異(p<0.05)。
試驗之三項檢測指標至少二項具統計顯著差異之改善效果,且其餘指標效果判定所憑之各條件,均無負向效果者,得初步判定該受試產品具牙齒保健功效。
伍、保健功效之宣稱
中央主管機關於核發健康食品許可證時,得依各別檢測指標試驗結果之判定,核可產品為「有助於提升口腔內牙菌斑酸鹼值」、「有助於減少口腔內牙菌斑堆積量」、「有助於減少口腔內牙菌斑內突變形鏈球菌數量」或其他相近具科學依據詞句之宣稱。
資料來源:衛生福利部食品藥物管理署
如您有健康食品查驗登記、成分包裝諮詢的需求,綠霖生技顧問為您提供最專業的諮詢服務,您可經由下方的按鈕與綠霖聯繫

